1. Hauptsatz
Jedes System besitzt eine extensive Zustandsgrösse Energie. Sie ist in einem abgeschlossenen System konstant. In einem abgeschlossenen System ist die Summe aller Veränderungen der Energie Null (zugeführte Energie wird positiv und abgeführte Energie wird negativ gezählt).
2. Hauptsatz
Alle natürlichen Prozesse sind irreversibel. Wärme kann nie von selbst von einem Körper niedriger auf einen Körper hoher Temperatur übergehen.
3. Hauptsatz
Die minimale Temperatur ist 0 K (- 273,15 °C).
Carnotfaktor, Energie gleich Exergie und Anergie
Energie kann nicht produziert oder vernichtet werden (1. Hauptsatz der Thermodynamik).
Energien haben aber eine unterschiedliche Wertigkeit, je höher die Temperatur, desto wertvoller ist die Energie. Wenn die Umgebungstemperatur zum Beispiel 20 °C beträgt, dann ist ein Energiespeicher mit 20 Liter Wasser auf einem Temperaturniveau von 40 °C weniger wert, als einer mit 10 Liter Wasser auf 60 °C, wobei beide den gleichen Energieinhalt von 1672 kJ (Wärmekapazität mal Temperaturdifferenz) gegenüber der Umgebungstemperatur von 20 °C haben. Wenn man in den Speicher mit 10 Liter auf 60 °C weitere beliebig vorhandene 10 Liter aus 20 °C Umgebungstemperatur hinzufügt, erhält man 20 Liter mit 40 °C. Diese Vermischung lässt sich ohne zusätzliche Energie nicht rückgängig machen (2. Hauptsatz der Thermodynamik).
Grundlage für die Bewertung ist der Energie auf verschiedenen Temperaturen ist der theoretisch maximale thermische Wirkungsgrad von Wärmekraftmaschinen, der Carnotfaktor. Dieser errechnet sich aus der Differenz der höchsten zur tiefsten Temperatur durch die höchste Temperatur in Kelvin (0 °C = 273,15 K) welche in einem Prozess vorkommen. Die theoretisch maximal gewinnbare mechanische Energie aus einer Temperaturdifferenzen wird mit dem Carnotfaktor beschrieben. In der Gleichung müssen die Temperaturen als Absolutwerte in Kelvin verwendet werden. \[\eta_{\text{Carnot}}=\frac{T_{\text{hoch}}-T_{\text{tief}}}{T_{\text{hoch}}}\]
Um die aus Wärme theoretisch gewinnbare mechanische Energie zu quantifizieren, gibt es die Begriffe Exergie und Anergie:
- Die Exergie ist die Energie, welche theoretisch in mechanische Energie umgewandelt werden kann.
- Die Anergie ist die Energie minus deren Exergie, also nur noch Wärme auf dem Niveau der Umgebungswärme.
- Die Energie ist die Summe aus Exergie und Anergie
Beispiel
Zwei unterschiedlich warme Wasserbehälter werden zusammen geschüttet.
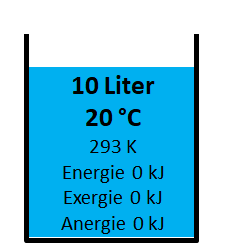
Kalter Wasserbehälter
Im 10 Liter Behälter mit 20 °C besteht keine Differenz zur Umgebungstemperatur, aus diesem Grund hat er keinen Energieinhalt. Energie, Exergie und Anergie ist 0 kJ.
\(Energie=m \cdot c_{\text{p}} \cdot (T_{\text{Medium}}-T_{\text{Umgebung}}) \) = 10 kg 4.18 kJ/kgK (293 K - 293 K) = 0 kJ
\(\eta_{\text{Carnot}}=\frac{T_{\text{Medium}}-T_{\text{Umgebung}}}{T_{\text{Medium}}}\) = (293 K - 293 K) / 293 K = 0 = 0 %
\(Exergie=\eta_{\text{Carnot}} \cdot Energie\) = 0 0 kJ = 0 kJ
\(Anergie=Energie - Exergie\) = 0 kJ - 0 kJ = 0 kJ
Heisser Wasserbehälter
Im 10 Liter Behälter mit 60 °C (333 K) besteht eine Differenz zur Umgebungstemperatur, aus diesem Grund hat er einen Energieinhalt.
\(Energie=m \cdot c_{\text{p}} \cdot (T_{\text{Medium}}-T_{\text{Umgebung}}) \) = 10 kg 4.18 kJ/kgK (333 K - 293 K) = 1672 kJ
\(\eta_{\text{Carnot}}=\frac{T_{\text{Medium}}-T_{\text{Umgebung}}}{T_{\text{Medium}}}\) = (333 K - 293 K) / 333 K = 0.12 = 12 %
\(Exergie=\eta_{\text{Carnot}} \cdot Energie\) = 0.12 1672 kJ = 200 kJ
\(Anergie=Energie - Exergie\) = 1672 kJ - 200 kJ = 1472 kJ

Warmer Wasserbehälter
Im zusammengeschütteten 20 Liter Behälter mit 40 °C (313 K) besteht eine Differenz zur Umgebungstemperatur, aus diesem Grund hat er einen Energieinhalt.
\(Energie=m \cdot c_{\text{p}} \cdot (T_{\text{Medium}}-T_{\text{Umgebung}}) \) = 20 kg 4.18 kJ/kgK (313 K - 293 K) = 1672 kJ
\(\eta_{\text{Carnot}}=\frac{T_{\text{Medium}}-T_{\text{Umgebung}}}{T_{\text{Medium}}}\) = (313 K - 293 K) / 313 K = 0.064 = 6 %
\(Exergie=\eta_{\text{Carnot}} \cdot Energie\) = 0.064 1672 kJ = 107 kJ
\(Anergie=Energie - Exergie\) = 1672 kJ - 107 kJ = 1565 kJ

Zusammenfassung
Durch das Zusammenschütten hat man keine Energie verloren, aber die Arbeitsmöglichkeit aus der Temperaturdifferenz zur Umgebung hat abgenommen. Bei diesem Beispiel hätte man theoretisch 200 kJ mechanische oder elektrische Energie gewinnen können, mit realen Anlagen (zum Beispiel OCR-Prozess oder Peltierelement) wegen dem kleinen Temperaturunterschied vielleicht 10 kJ. Der Vorgang ist ohne zusätzlichen Energieaufwand irreversibel. Mit einer Wärmepumpe oder einem Peltierelement kann man aus den 40 °C warmen Behälter wieder in einen kalten mit 20 °C und einen warmen mit über 60 °C auftrennen. Über 60 ° C, weil die erforderliche mechanische oder elektrische Energie zusätzliche Wärmeenergie ergibt.
Mechanische und elektrische Energie ist reine Exergie.
Die gleichen Gesetzmässigkeiten gelten auch für Temperaturen unter der Umgebungstemperatur.

